燃料電池

燃料電池は、燃料が持つ化学エネルギーを燃焼せずにセルスタックで直接電気エネルギーに変換できるため、発電効率が高く、二酸化炭素の排出量を低減することが可能なシステムです。天然ガス、バイオマス、水素など多種多様な燃料の使用が可能です。
発電原理
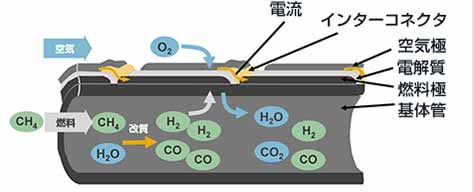
SOFCは、燃料極に燃料ガス(水素や一酸化炭素など)、空気極に空気(酸素)を供給して、摂氏700度~1000度の温度で発電します。
セルスタックに投入される燃料ガスの主成分であるメタン(CH4)と、再循環される排燃料に含まれる水蒸気(H2O)は、SOFCの特徴である内部改質反応によってセルスタックの内部で水素(H2)と一酸化炭素(CO)になります。
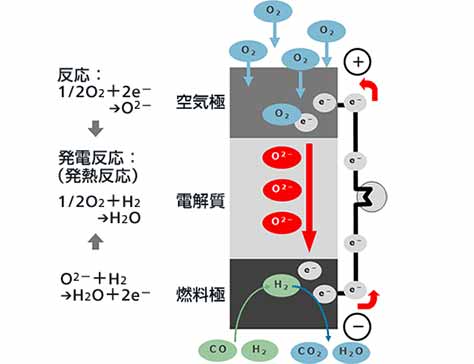
空気極側から電解質中を移動してくる酸素イオン(O2-)が燃料極と電解質の界面で、燃料の水素(H2)や一酸化炭素(CO)と反応して、電子(e-)を放出すると同時に、水蒸気(H2O)あるいは二酸化炭素(CO2)を生成します。
一方、酸素イオンから放出された電子は、外部電気回路を通って電気的な仕事をした後、空気極に移動します。
空気極と電解質の界面では、空気中の酸素(O2)が、移動してきた電子と反応し酸素イオンになり、この酸素イオンは電解質中に取り込まれて燃料極側に移動します。
発電の全体の反応としては、水素あるいは一酸化炭素と酸素が反応して水あるいは二酸化炭素が生成し、電子が外部回路を移動することで、電気が流れます。
空気極が正極(カソード)、燃料極が負極(アノード)となります。